Epilepsia afectează aproximativ 50 de milioane de persoane la nivel mondial, iar în aproximativ o treime dintre cazuri devine refractară la tratamentul medicamentos, necesitând adesea intervenție chirurgicală. Protocoalele dedicate de RMN și PET/CT cu FDG, conform ghidurilor EANM, joacă un rol esențial în identificarea leziunilor epileptogene.
Ca analog radioactiv al glucozei, PET cu [18F]FDG este utilizat frecvent pentru evaluarea metabolismului cerebral, evidențiind interictal (perioada de “liniste” dintre crizele epileptice) de obicei zone de hipometabolism. Această reducere a captării trasorului a fost asociată cu multiple mecanisme subiacente, inclusiv degenerescența neuronală, modificări ale activității sinaptice și alte perturbări legate de epilepsie, precum modificările vasculare postictale sau suprimarea metabolică tranzitorie. În plus, factori precum durata epilepsiei, frecvența crizelor, efectele medicației antiepileptice (ASM), intervalul de timp de la ultima criză și tipul crizei (de exemplu, generalizată sau atipică) pot contribui suplimentar la variațiile modelelor de captare a [18F]FDG.
Scleroza hipocampică mezială (MTS)
reprezintă cea mai frecventă cauză de epilepsie lobară temporală (TLE) refractară la tratament, fiind caracterizată prin cicatrizare hipocampică și pierdere neuronală. Deși fiziopatologia exactă a MTS rămâne neclară, crizele prelungite, leziunile hipoxic-ischemice și inflamația sunt factori probabili contribuitori.
RMN detectează MTS la 60–70% dintre pacienții cu TLE, evidențiind atrofie hipocampică, subțierea fornixului și lărgirea cornului temporal adiacent și/sau a fisurii coroidiene. De obicei, MTS nu prezintă captare de contrast. Secvențele T2/FLAIR evidențiază hiperintensitate, în timp ce DWI arată difuzivitate crescută. Spectroscopia RMN (MRS) indică reducerea nivelurilor de N-acetilaspartat (NAA) din cauza pierderii neuronale, iar DTI/fMRI evidențiază modificări structurale și funcționale extinse dincolo de hipocamp.
PET cu [18F]FDG este un instrument extrem de sensibil pentru identificarea MTS, evidențiind în mod caracteristic hipometabolism la nivelul lobului temporal. Aceste descoperiri imagistice sunt esențiale pentru diagnosticul MTS și pentru ghidarea deciziilor chirurgicale în managementul epilepsiei.
Anomaliile de dezvoltare
contribuie semnificativ la epilepsia refractară, malformații precum displazia corticală focală (FCD), heterotopia, polimicrogiria, hemimegalencefalia și schizencefalia afectând organizarea corticală și predispunând pacienții la activitate epileptică persistentă.
Displazia corticală focală (FCD) reprezintă o cauză semnificativă a epilepsiei refractare, intervenția chirurgicală fiind adesea necesară. Imagistica joacă un rol esențial în diagnosticarea FCD și în ghidarea deciziilor terapeutice, deși nu toate leziunile confirmate histologic sunt detectabile imagistic.
FCD este clasificată în trei tipuri principale (I, II, III) în funcție de natura malformației corticale și caracteristicile asociate:
- FCD Tip I se caracterizează prin malformații izolate ale structurii corticale, în special anomalii ale stratificării corticale.
- FCD Tip II este mai frecventă decât Tip I și se caracterizează prin alterarea stratificării corticale și prezența neuronilor dismorfi, care sunt neuroni cu morfologie anormală și funcție defectuoasă.
- FCD Tip III nu este o malformație corticală izolată, ci un defect postmigrațional, apărut ca urmare a unei dezvoltări anormale după migrarea neuronilor către locațiile lor finale. Este asociată cu evenimente patologice precum ischemia, infecțiile, traumatismele sau alți factori dobândiți.
Caracteristici generale RMN ale FCD:
- Îngroșarea corticală
- Neclaritatea joncțiunii substanță albă-substanță cenușie, adesea cu arhitectură subcorticală anormală
- Hiperintensitate T2/FLAIR în substanța albă, cu sau fără semnul transmantle (anomalie focală de semnal care se extinde de la cortex până la ventricul)
- Hiperintensitate T2/FLAIR în substanța cenușie
- Model anormal al girificării sau sulcației
- Hipoplazie/atrofie segmentară sau lobară
- Absența edemului, calcificărilor sau captării de contrast
PET/CT cu [18F]FDG evidențiază hipometabolism în cortexul displazic, reflectând disfuncția neuronală.
Polimicrogiria (PMG) este o malformație de dezvoltare cerebrală caracterizată printr-un cortex anormal de îngroșat, cu numeroase girificații mici și șanțuri slab definite, conferind creierului un aspect rugos și neregulat. Cel mai frecvent, acest model este observat bilateral în regiunea perisylviană (61%). PMG coexista frecvent cu heterotopia substanței cenușii periventriculare (11%) și afecțiuni precum schizencefalia, fiind puternic asociată cu infecția congenitală cu citomegalovirus (CMV).
Caracteristici imagistice ale PMG:
- RMN este tehnica imagistică de elecție.
- Cortex îngroșat, cu contururi neregulate și graniță indistinctă între substanța cenușie și albă.
- Anomalii frecvente la nivelul ganglionilor bazali.
- Pe secvențele T2, semnal crescut în substanța albă subiacentă (20-27%), posibil din cauza expansiunii spațiilor perivasculare.
- Calcificările sunt rare (<5%), mai frecvent întâlnite în cazurile asociate cu infecții congenitale.
- Pe secvențele DWI, valori ADC crescute în substanța albă afectată, structurile cenușii profunde și corpul calos.
- Hipometabolism pe FDG PET/CT cerebral.
Hemimegalencefalia (HMEG)
Hemimegalencefalia este o malformație corticală rară caracterizată prin mărirea anormală a unui emisfer cerebral, cu creștere asimetrică a creierului, cortex îngroșat și girificație anormală vizibilă pe RMN. Emisfera afectată poate prezenta asimetrie ventriculară, anomalii ale substanței albe și hiperintensități T2, fiind adesea asociată cu epilepsie refractară, întârziere în dezvoltare și hemipareză.
FDG-PET în hemimegalencefalie:
- Hipermetabolism în copilăria timpurie.
- Hipometabolism progresiv ulterior, din cauza disfuncției neuronale.
- Captare asimetrică a glucozei, cu anomalii metabolice focale corelate cu displazia corticală și zonele epileptogene.
Schizencefalia
Schizencefalia este o malformație caracterizată prin prezența unor fisuri unilaterale sau bilaterale care se extind de la ventriculi până la suprafața corticală, fiind delimitate de substanță cenușie. Se vizualizează optim pe RMN.
Tipuri imagistice de schizencefalie:
- Tip „closed-lip” – fisuri înguste, fără dilatarea lichidului cefalorahidian (LCR).
- Tip „open-lip” – fisuri largi, umplute cu LCR, asociate cu simptome mai severe.
Imagistic, schizencefalia se distinge de porencefalie prin prezența substanței cenușii care tapetează fisurile, un element absent în porencefalie.
Tumori
Gangliogliomul (GG) și tumora neuroepitelială disembrioplastică (DNET) sunt cele mai frecvente tumori asociate cu epilepsia refractară atât la copii, cât și la adulți. Ambele sunt tumori benigne, de obicei localizate cortical, și sunt adesea asociate cu displazie corticală. Mai mult de 75% dintre gangliogliome și aproape jumătate dintre DNET-uri apar în lobul temporal și sunt clasificate ca neoplasme de gradul I conform clasificării OMS, cu posibilă transformare malignă în cazul apariției anaplaziei.
Gangliogliomul este o leziune corticală superficială care prezintă două tipare imagistice principale: primul tipar constă într-o masă bine delimitată, solidă sau parțial chistică, cu un nodul mural, iar al doilea tipar constă într-o masă cu infiltrare difuză, cu margini slab definite și captare de contrast neregulată, acest al doilea tipar fiind rar întâlnit. Pe imagistica prin rezonanță magnetică, gangliogliomul apare ca o leziune hipo- până la izointensă pe secvențele T1 și hiperintensă pe secvențele T2/FLAIR, fără edem peritumoral. Captarea de contrast este variabilă, cel mai frecvent prezentându-se sub forma unei mase chistice cu nodul mural enhanciv, în timp ce enhancement-ul neregulat sau „patchy” este mai puțin frecvent și poate indica un prognostic mai rezervat. Calcificările sunt rare, iar hemoragia este neobișnuită.
Tumora neuroepitelială disembrioplastică este o tumoră intracorticală care determină îngroșarea și expansiunea girală, iar componenta sa glioneuronală are în mod tipic o consistență vâscoasă, împreună cu unul sau mai mulți noduli mai fermi, ceea ce îi conferă un aspect distinctiv. Pe tomografia computerizată, DNET apare ca o masă corticală sau subcorticală hipodensă, cu calcificări prezente în aproximativ 20% dintre cazuri și cu posibilă remodelare osoasă dacă tumora este situată în apropierea calvariei. Pe imagistica prin rezonanță magnetică, DNET are un aspect multilobulat, cu caracter „bubbly” (asemănător unor bule), fiind puternic hiperintensă pe secvențele T2 ponderate. Pe secvențele FLAIR, prezintă frecvent un inel periferic hiperintens în aproximativ 75% din cazuri. Nu există edem peritumoral, iar captarea de contrast este minimă sau absentă, ocazional observându-se un pattern nodular sau punctiform discret.
Astrocitoamele pleomorfice xanthoastrocitare (PXA) se prezintă sub forma unei leziuni de tip „chist + nodul”, situată adiacent sau atașată leptomeningelui, cu captare moderată de contrast și localizare superficial corticală, predominant în lobul temporal. Alternativ, pot apărea sub formă de masă predominant solidă, cu chisturi intratumorale. Sunt clasificate ca neoplasme de gradul II conform OMS.
Hamartomul hipotalamic este o masă hipotalamică omogenă, fără captare de contrast, frecvent asociată cu crize gelastice.
Gliomele temporale de grad scăzut, incluzând astrocitoamele pilocitice și astrocitoamele difuze, apar hiperintense pe secvențele T2 ponderate, cu captare variabilă de contrast, adesea fără edem semnificativ. Acestea sunt frecvent asociate cu scleroza hipocampică și displazia corticală focală.
Pe tomografia cu emisie de pozitroni cu fluorodeoxiglucoză ([18F]FDG PET/CT) cerebrală, tumorile neuroepiteliale disembrioplastice (DNET) și gliomele de grad scăzut sunt de obicei hipometabolice, însă pot prezenta hipermetabolism discret în cazul unei transformări maligne. Gangliogliomul prezintă frecvent un ușor hipermetabolism în componentele sale solide.
Encefalita Rasmussen (ER),
cunoscută și sub denumirea de encefalită focală cronică, este o afecțiune neurologică rară, progresivă, caracterizată prin epilepsie farmacorezistentă, hemipareză progresivă și declin cognitiv. Cauza exactă rămâne necunoscută, însă se presupune implicarea unei infecții virale sau a unui mecanism autoimun. Simptomele debutează de obicei între 1,5 și 14 ani.
Constatări imagistice:
• Examinarea prin RMN în stadiile incipiente poate fi normală, însă ulterior evidențiază hiperintensitate pe secvențele T2/FLAIR la nivelul cortexului și substanței albe subcorticale din emisfera afectată.
• Regiunea perisilviană este frecvent implicată, cu apariția progresivă a atrofiei cerebrale și dilatarea ventriculară în decurs de câteva luni de la debutul bolii.
• Atrofia nucleului caudat ipsilateral este un semn timpuriu comun.
• Extensia și fluctuația modificărilor de semnal pot corela cu activitatea epileptică la unii pacienți.
Studiile funcționale utilizând tomografia cu emisie de pozitroni cu fluorodeoxiglucoză ([18F]FDG PET) evidențiază hipometabolism cerebral unilateral difuz, care poate fi detectat chiar și atunci când atrofia cerebrală pe RMN este minimă.
Sindromul Sturge-Weber (SWS),
cunoscut și sub denumirea de angiomatoză encefalo-trigeminală, este caracterizat prin:
- Vasculita portocalie la naștere (PWB) în distribuția nervului trigemen.
- Angiom retinal choroidal, cu sau fără glaucom.
- Angiom leptomeningeal, o aglomerare de vase capilare-vene anormale ce acoperă creierul, cel mai frecvent în regiunea parieto-occipitală.
Constatări imagistice neuro:
• CT: Calcificări distrofice corticale/subcorticale, atrofie corticală și plex choroidal ipsilateral mărit. CT-ul osos arată mărirea sinusului frontal și îngroșarea diploică datorată pierderii de volum cerebral.
• RMN: Atrofie corticală, spații subarahnoidiene mărite, calcificări hipointense pe T2, și semnul „ivy” pe secvențele FLAIR. După administrarea de contrast, T1WI/FLAIR relevă enhancement-ul angiomei piale serpentinoase, care se extinde în sulcuri. Venele medulare mărite pot fi vizibile ca structuri liniare cu enhancement.
Imagistica SWS ajută la evaluarea atrofiei corticale progresive și a schimbărilor ischemice venoase. Pe tomografia cu emisie de pozitroni cu fluorodeoxiglucoză ([18F]FDG PET/CT) cerebrală, aceasta arată hipometabolism în emisfera afectată și, uneori, metabolism crescut în plexul choroidal ipsilateral.
Concluzii și elemente cheie
Epilepsia afectează 50 de milioane de oameni, dintre care o treime sunt rezistenți la medicamente, adesea necesitând imagistică pentru planificarea intervenției chirurgicale. RMN-ul și FDG-PET CT sunt esențiale în detectarea focarelor epileptogene. FDG-PET arată de obicei hipometabolism în regiunile cerebrale afectate din cauza disfuncției neuronale.
- Scleroza Temporală Mesială (MTS): Cea mai frecventă cauză a epilepsiei incontrolabile a lobului temporal (TLE). RMN-ul arată atrofie hipocampală, hiperintensitate pe T2/FLAIR și subțierea fornixului. FDG-PET arată hipometabolism în lobul temporal.
• Displazia Corticală Focală (FCD): O cauză majoră a epilepsiei incontrolabile, clasificată în Tip I, II și III. Caracteristicile RMN includ îngroșarea corticală, estomparea joncțiunii materiei cenușii-albe și hiperintensitate pe T2/FLAIR. FDG-PET arată hipometabolism în cortexul displazic.
• Heterotopia: Substanță cenușie plasată anormal, cauzând epilepsie. RMN-ul arată noduli izointenși, fără îmbunătățire sau edem. FDG-PET arată metabolism variabil, adesea normal sau hipometabolic în cazurile de epilepsie.
• Polimicrogiria (PMG): Cortexul anormal de gros, cu pliuri excesive. RMN-ul arată îngroșarea corticală, sulci neregulați și hiperintensitate pe T2. FDG-PET: Cortex hipometabolic.
• Hemimegalencefalie (HMEG): O emisferă este mărită cu gyralizație anormală. RMN-ul arată displazie corticală și anomalii ale substanței albe. FDG-PET: Hipermetabolism în copilărie, hipometabolism ulterior.
• Schizencefalie: Fisuri umplute cu LCR, căptușite cu substanță cenușie. RMN-ul o distinge de porencefalie. FDG-PET: De obicei hipometabolic.
• Tumori (DNET, Gangliogliom, Gliome de grad scăzut): Frecvente în epilepsie, în principal în lobul temporal. RMN-ul variază în funcție de tipul tumorii. FDG-PET: o DNET și Gliome de grad scăzut → Hipometabolice (hipermetabolism ușor dacă apare transformare malignă). o Gangliogliome → Hipermetabolism ușor în componentele solide.
• Encefalita Rasmussen (RE): Epilepsie progresivă cu atrofie cerebrală unilaterale. RMN-ul arată hiperintensitate pe T2/FLAIR și atrofie progresivă. FDG-PET: Hipometabolism unilateral.
• Sindromul Sturge-Weber (SWS): Caracterizat prin pată portocalie, angiom retinal și angiom leptomeningeal. RMN-ul arată atrofie corticală, calcificări și îmbunătățirea angiomei piale. FDG-PET: Hipometabolism în emisferă, hipermetabolism ipsilateral al plexului choroid.
Modele cheie de FDG-PET în afecțiuni legate de epilepsie: • Hipometabolism → MTS, FCD, PMG, Schizencefalie, HMEG (mai târziu), Encefalita Rasmussen, SWS.
• Hipermetabolism → HMEG (în primii ani), Gangliogliome (ușor), Plex choroidal (SWS).
• Metabolism variabil → Heterotopia, DNET-uri, FCD (în funcție de activitatea crizală).
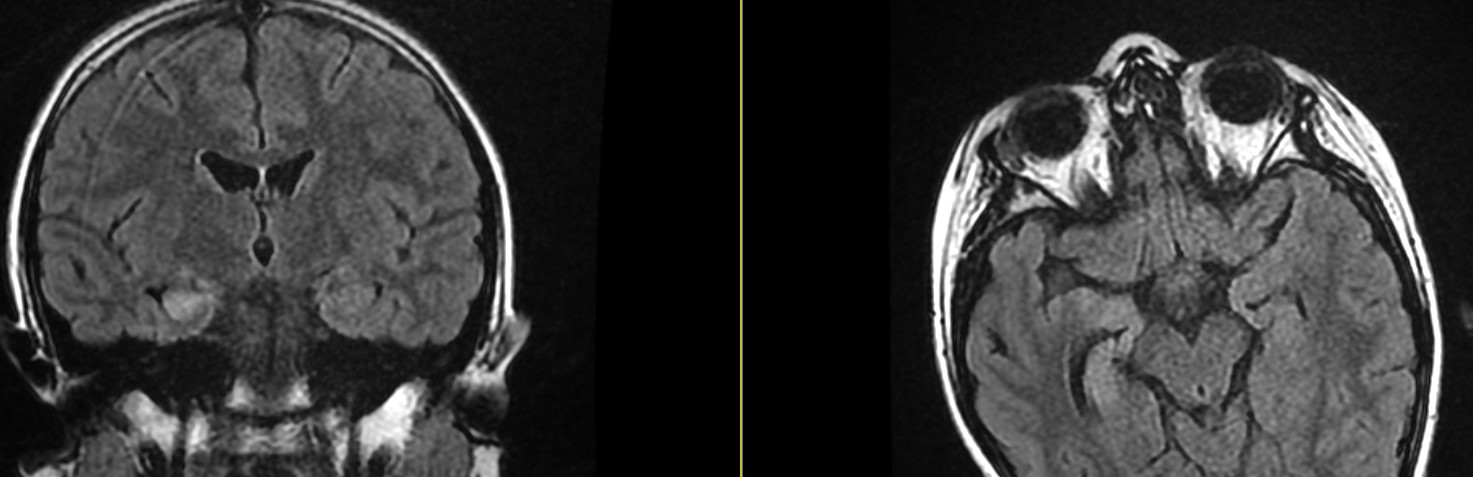
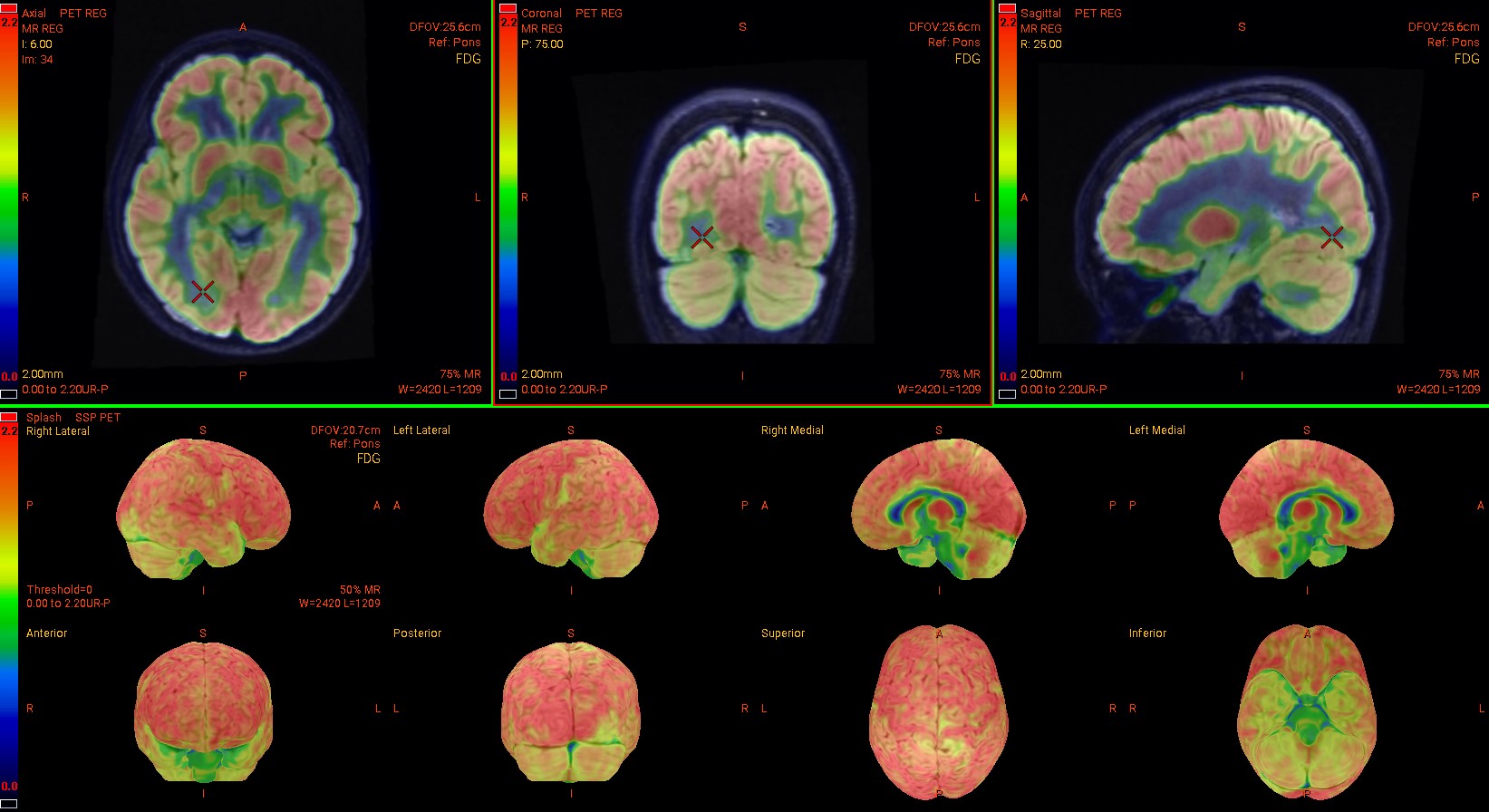
MTS
RMN secțiuni coronale și axiale FLAIR: Scleroză temporală mezială pe partea dreaptă, cu pierdere de volum a hipocampului, ceea ce indică atrofie și determină o lărgire secundară a cornului temporal al ventriculului lateral; semnalul FLAIR ridicat indică glioză;
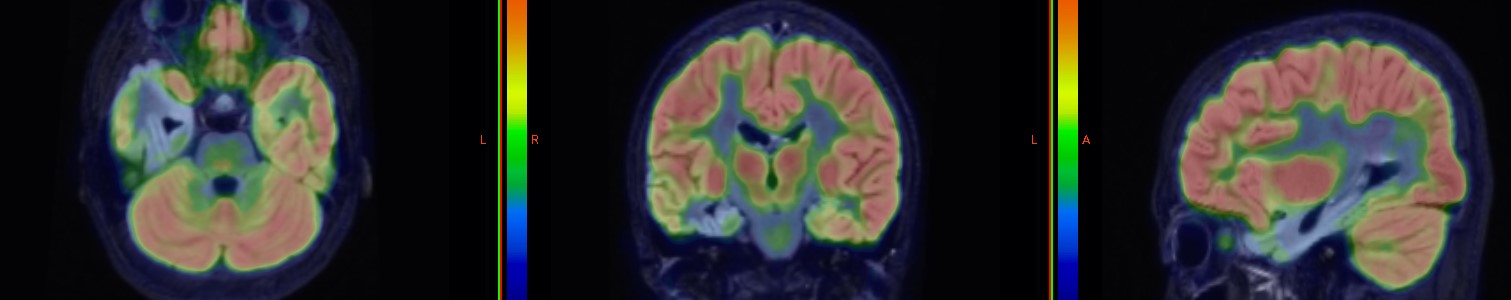
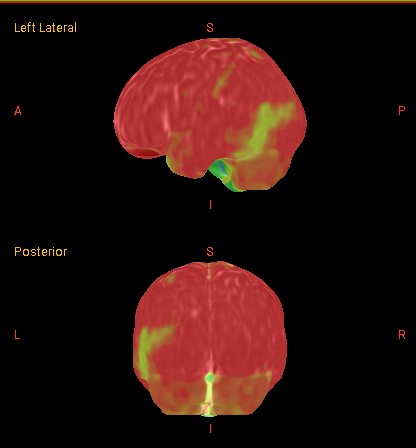
IRM 3D fuzionat cu PET/CT FDG Scleroză temporală mezială (MTS) pe partea dreaptă, asociată cu epilepsie de lob temporal (zonă extinsă de hipometabolism în lobul temporal drept).
Studii IRM fuzionat cu PET/CT FDG: Scleroză temporală mezială (MTS) pe partea dreaptă, cu atrofie a hipocampului și lărgire a cornului temporal drept al ventriculului lateral; zonă extinsă cu hipometabolism marcat evidențiat prin FDG.
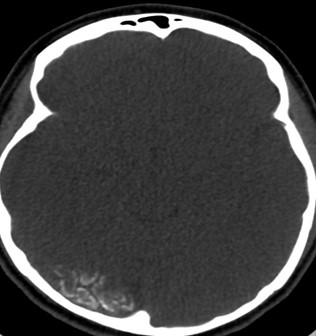
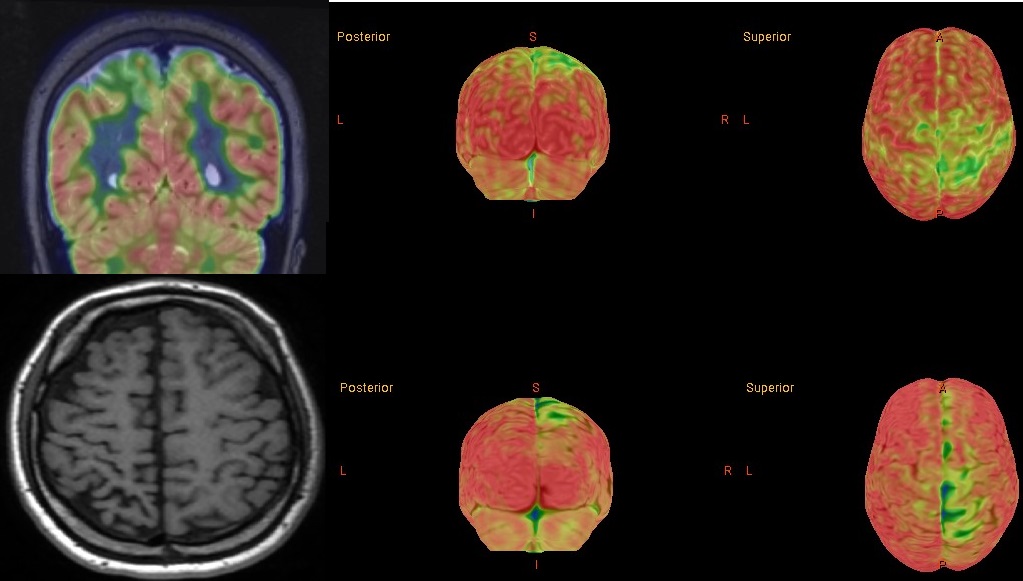
Sturge webber
CT, fereastră osoasă: Sindrom Sturge-Weber: Calcificări subcorticale și pierdere asociată de volum parenchimatos (nu este vizibilă aici); semnul „tramvaiului” (tram-track).
IRM fuzionat cu PET/CT FDG; Sindrom Sturge-Weber: Zonă occipitală dreaptă cu hipometabolism, asociată cu pierdere de volum parenchimatos.
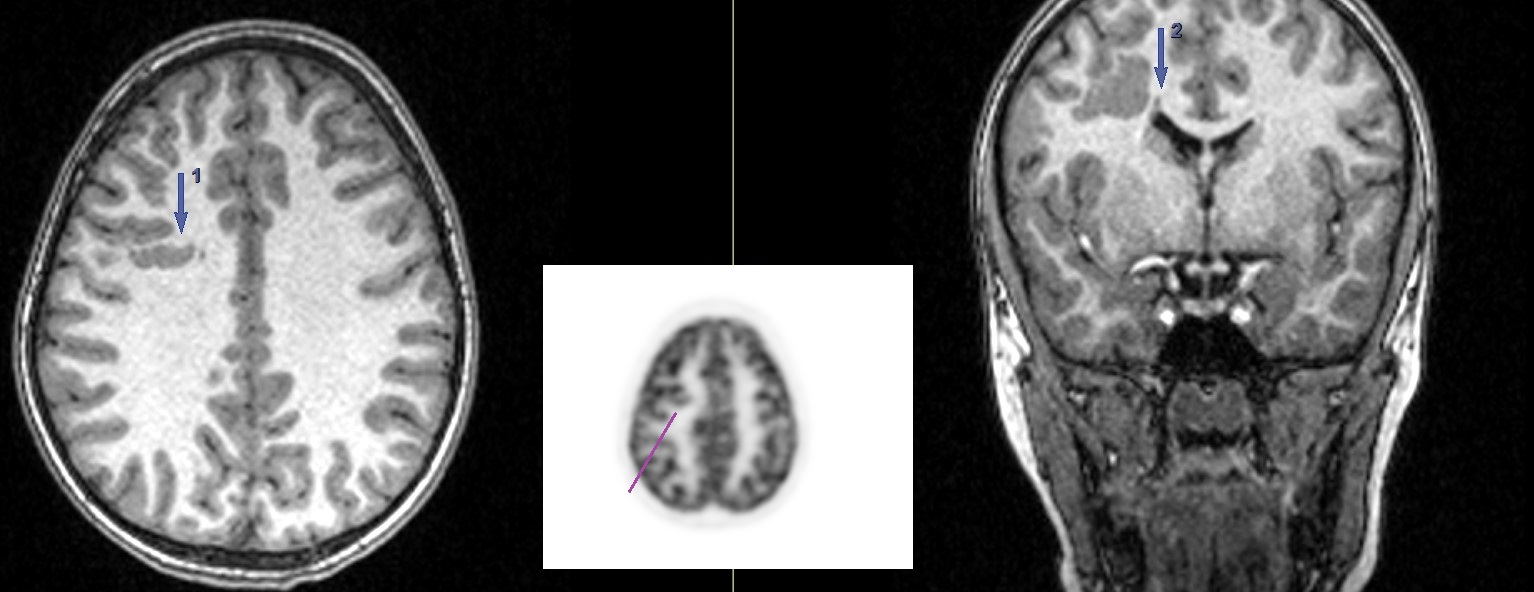
Heterotopie
IRM axial și coronal T1; proiecție MIP din studiul PET/CT cu FDG: Heterotopie de substanță cenușie subcorticală (săgeata 1) și periventriculară (săgeata 2), observată ca țesut heterotopic care urmează semnalul substanței cenușii în toate secvențele; substanță cenușie subcorticală hipermetabolică (linie mov).
Rassmusen
IRM coronal fuzionat cu PET/CT FDG, reconstrucție 3D, T1 axial:
(primul rând) Encefalită Rasmussen focală, afectând girusul post-central drept, care este atrofiat, cu șanțuri lărgite și metabolism glucozic redus.
(al doilea rând) Encefalită Rasmussen extinsă pe întreaga emisferă dreaptă, cu atrofie a emisferei drepte, șanțuri lărgite, atrofie a nucleului caudat de aceeași parte (ipsilateral) și dilatare ventriculară „ex vacuo” (nu este vizibilă aici), emisfera dreaptă fiind global hipometabolică.
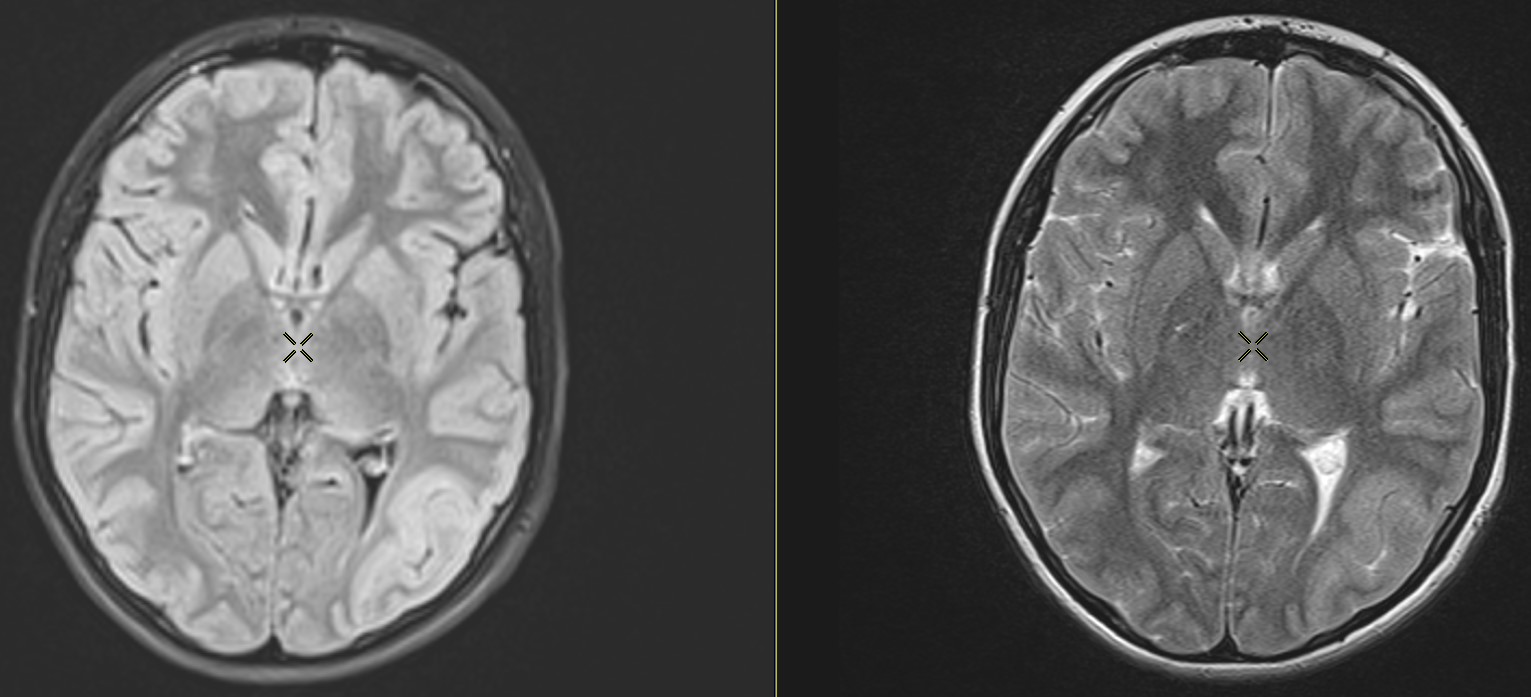
Displazie corticala
IRM axial T2 și FLAIR: Îngroșare corticală, estompare a joncțiunii dintre substanța albă și cea cenușie, hipersinal T2/FLAIR al substanței cenușii și albe, fără restricție de difuziune, fără captare de contrast, implicând fisura occipito-temporală
IRM fuzionat cu PET/CT FDG arată o zonă cu hipometabolism crescut.
Reminiscenta post-interventie
Serii 3D fuzionate IRM și PET/CT FDG: Acest pacient a suferit o rezecție chirurgicală a unei displazii corticale focale și a rămas cu o cavitate encefalomalacicǎ. Așa cum se poate observa în imagini, se poate vedea o zonă de 15 mm de parenchim cerebral la capătul distal al girusului frontal stâng mijlociu, care prezintă activitate hipometabolică. Acest lucru a fost considerat compatibil cu un focar epileptic rezidual.